SINTESIS
ALKUNA
(Synthesis Of Alkynes)
Alkuna merupakan suatu golongan hidrokarbon alifatik yang
mempunyai gugus fungsi berupa ikatan rangkap tiga karbonkarbon. Seperti halnya
ikatan rangkap pada alkena, ikatan rangkap tiga pada alkuna juga disebut ikatan
tidak jenuh. Ketidak jenuhan ikatan rangkap tiga karbon-karbon lebih besar dari
pada ikatan rangkap dua pada alkena. Alkuna sangat
tidak stabil dan sangat reaktif. Salah satunya adalah etuna yang
disebut juga sebagai asetilen dalam perdagangan atau sebagai pengelasan. Alkuna dapat
dibuat melalui alkilasi, melalui reaksi berkatalis Pd, dan melalui metatesis.
1. Melalui Alkilasi
Alkilasi merupakan suatu reaksi yang mana
terjadinya penambahan suatu gugus alkil pada suatu kerangka molekul.
v Terminal alkuna tidak biasa
untuk hidrokarbon sederhana karena dapat dideprotonasikan (pKa = 26)
menggunakan basis yang tepat (biasanya NaNH2, pKa = 36) untuk menghasilkan
karbanion.
v
Karbanion asetil adalah nukleofil
C yang baik dan dapat mengalami reaksi substitusi nukleofilik (biasanya SN2)
dengan 1o atau 2o alkil halida (Cl, Br atau I) yang memiliki elektrofilik C
untuk menghasilkan alkuna internal.
v
3˚ alkil halida lebih mungkin untuk
menjalani eliminasi.
v Salah satu atau
kedua atom H terminal dalam etilena (asetilena) HC≡CH dapat di susbtituted
menyediakan akses ke monosubstitusi (RC≡CH) dan simetris (R = R ') atau
unsymmetrical (R tidak sama dengan R') alkina disubstitusi RC≡ CR '
Mekanisme
reaksi alkilasi pada asetilida (dengan bromoetana) :
Langkah 1:
Reaksi asam / basa.
Ion amida
bertindak sebagai basis untuk menghilangkan terminal asam H untuk menghasilkan
ion asetilida, nukleofil karbon.
Langkah 2:
Reaksi substitusi nukleofilik.
Reaksi substitusi nukleofilik.
Carbanion bereaksi
dengan karbon elektrofilik dalam alkil halida dengan hilangnya kelompok yang
meninggalkan, membentuk ikatan C-C baru.
Alkilasi
alkuna tidak hanya terjadi untuk asetilena saja, tetapi juga pada terminal
alkuna yang lain. Alkilasi terminal alkuna dapat menghasilkan internal alkuna.
Contohnya 1-heksuna dikonversi menjadi anionnya, lalu direaksikan dengan
1bromobutana, hasilnya adalah 5-dekuna.
Alkilasi 1-heksuna
Terminal alkuna dapat diperoleh dari alkilasi asetilena,
sedangkan internal alkuna diperoleh dari alkilasi terminal alkuna.
Reaksi umum alkilasi alkuna
Alkilasi ion asetilida hanya terbatas pada alkil bromida
primer dan alkil iodida saja. Hal ini karena anion asetilida merupakan basa
kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru
akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
2.
Melalui reaksi berkatalis paladium
Luminasi
intermolekular yang dikatalisasi oleh paladium sangat efektif untuk sintesis
berbagai heterocycles.30 Reaksi biasanya terjadi mulai dari aril atau vinyl
halida yang mengandung nukleofil 23 yang berdekatan oksidatif palladated ke 24.
Setelah cis carbopalladation berikutnya dari alkuna terkemuka hingga 25,
nukleofil internal dapat mempengaruhi perpindahan intramolekular paladium menuju
heterocycle 27, mungkin dengan pembentukan sebelumnya palladac 26 dan eliminasi
reduktif (Skema 10) .30b
Contoh penerapan
sintesis heterosiklik ini adalah persiapan pyrroles sangat tersubstitusi,
seperti 29, oleh reaksi antara iodoenamines yang stabil, seperti 28, dengan
alkuna internal, reaksi dikatalisis oleh Pd (OAc) 2 (5 mol%) dikehadiran LiCl
sebagai aditif dan kalium karbonat sebagai dasar dalam DMF pada 65 ºC (Skema
11) .31
Kerangka indole
adalah salah satu yang paling penting di dunia heterosiklik karena kehadiran
mereka dalam sejumlah besar sistem biologis aktif yang menarik, dan sintesis
mereka melalui reaksi katalis-paladium telah sangat intens.30b, 30d, 32
Di antara metodologi yang dikembangkan, reaksi paladium-katalis intermolecular derivatif o-iodoaniline dengan alkuna internal (indole intermolecular Larock sintesis) ditunjukkan sebagai prosedur yang kuat untuk persiapan 2,3-disubstitusi indoles dari alkynes.33 demikian, dengan adanya jumlah katalitik Pd (OAc) 2 (5% mol), sumber anion klorida (nBu4NCl atau LiCl) dan basis seperti kalium karbonat atau asetat dalam DMF pada 100 ºC, turunan o-iodoaniline ditambahkan secara formal alkuna internal untuk memberikan 2,3-disubstitusi indoles, seperti yang dicontohkan dalam Skema 12, dengan persiapan indole 31 dari iodoaniline 30 dan 4,4-dimethylpent-2-yne.33b As diamati, kelompok yang lebih terhalang secara sterik pada bagian alkyne biasanya menempel pada posisi C-2 dari indole. Proses ini juga telah dilakukan menggunakan oxime-derived palladacycles hanya menggunakan 1 mol% dari katalis, kalium karbonat sebagai basis di hadapan TBAB di DMF pada 130 ºC.27a Terlepas dari kondisi yang sangat ionik ini, yang menunjukkan keberadaan spesies palladium bermuatan, sebagian besar pendekatan mekanistik untuk reaksi ini didasarkan pada kondisi netral. Selain itu, versi heterogen dari pencabutan Larock ini telah dilaporkan.34 Dengan demikian, paladium (2% mol) telah didukung pada NaY zeolit, yang telah memungkinkan menekan keberadaan sumber klorida dan mendaur ulang katalis hingga empat kali, 34a dan pada silika mesopori SBA15.34b Selain itu, penggunaan Pd / C sebagai katalis (2% mol) telah memungkinkan persiapan indoles mulai dari o-bromoanilines yang kurang reaktif, reaksi yang terjadi di dalam adanya natrium karbonat sebagai basa, dalam DMF sebagai pelarut pada 140 ºC, seperti yang ditunjukkan pada Skema 12 dengan persiapan indole 33 dari o-bromoaniline 32 dan diphenylacetylene.34c Selain itu, sistem terkait lainnya seperti 2,3-disubstitusi 5 azaindoles baru-baru ini diperoleh dengan menggunakan reaksi heteroannulation antara 4 acetamido-3-iodopyrydines dan alkynes internal di bawah PdCl2 (PPh3) 2 katalisis (5% mol).
Di antara metodologi yang dikembangkan, reaksi paladium-katalis intermolecular derivatif o-iodoaniline dengan alkuna internal (indole intermolecular Larock sintesis) ditunjukkan sebagai prosedur yang kuat untuk persiapan 2,3-disubstitusi indoles dari alkynes.33 demikian, dengan adanya jumlah katalitik Pd (OAc) 2 (5% mol), sumber anion klorida (nBu4NCl atau LiCl) dan basis seperti kalium karbonat atau asetat dalam DMF pada 100 ºC, turunan o-iodoaniline ditambahkan secara formal alkuna internal untuk memberikan 2,3-disubstitusi indoles, seperti yang dicontohkan dalam Skema 12, dengan persiapan indole 31 dari iodoaniline 30 dan 4,4-dimethylpent-2-yne.33b As diamati, kelompok yang lebih terhalang secara sterik pada bagian alkyne biasanya menempel pada posisi C-2 dari indole. Proses ini juga telah dilakukan menggunakan oxime-derived palladacycles hanya menggunakan 1 mol% dari katalis, kalium karbonat sebagai basis di hadapan TBAB di DMF pada 130 ºC.27a Terlepas dari kondisi yang sangat ionik ini, yang menunjukkan keberadaan spesies palladium bermuatan, sebagian besar pendekatan mekanistik untuk reaksi ini didasarkan pada kondisi netral. Selain itu, versi heterogen dari pencabutan Larock ini telah dilaporkan.34 Dengan demikian, paladium (2% mol) telah didukung pada NaY zeolit, yang telah memungkinkan menekan keberadaan sumber klorida dan mendaur ulang katalis hingga empat kali, 34a dan pada silika mesopori SBA15.34b Selain itu, penggunaan Pd / C sebagai katalis (2% mol) telah memungkinkan persiapan indoles mulai dari o-bromoanilines yang kurang reaktif, reaksi yang terjadi di dalam adanya natrium karbonat sebagai basa, dalam DMF sebagai pelarut pada 140 ºC, seperti yang ditunjukkan pada Skema 12 dengan persiapan indole 33 dari o-bromoaniline 32 dan diphenylacetylene.34c Selain itu, sistem terkait lainnya seperti 2,3-disubstitusi 5 azaindoles baru-baru ini diperoleh dengan menggunakan reaksi heteroannulation antara 4 acetamido-3-iodopyrydines dan alkynes internal di bawah PdCl2 (PPh3) 2 katalisis (5% mol).

Prosedur berbeda yang memungkinkan
penggunaan anilin terhalogenasi kurang reaktif derivatif atau sistem halogenasi
lainnya sebagai prekursor dalam sintesis Larock indole sebelumnya telah
dikembangkan.32e, f Dengan demikian, o-bromo- atau bahkan o-kloroanilin,
seperti 35,
telah digunakan dalam penambahan formal intramolekul alkuna internal, seperti 36, mengarah ke indoles, seperti 37 (rasio 91: 9 regioisomer), dalam suatu proses yang dikatalisasi oleh a
kombinasi Pd (OAc) 2 dan ligan ferrocene yang diturunkan 34 dengan adanya kalium karbonat dalam NMP sebagai pelarut pada 110 atau 130 ºC (Skema 13).
telah digunakan dalam penambahan formal intramolekul alkuna internal, seperti 36, mengarah ke indoles, seperti 37 (rasio 91: 9 regioisomer), dalam suatu proses yang dikatalisasi oleh a
kombinasi Pd (OAc) 2 dan ligan ferrocene yang diturunkan 34 dengan adanya kalium karbonat dalam NMP sebagai pelarut pada 110 atau 130 ºC (Skema 13).

3. Melalui Metatesis
Metatesis Reaksi merupakan suatu pertukaran
ikatan antara dua spesies kimia yang bereaksi. Reaksi
metatesis disebut juga reaksi pertukaran ganda. Contohnya yaitu :


Permasalahan :
1.
Kenapa Alkilasi ion asetilida hanya terbatas pada alkil bromida primer dan
alkil iodida saja?
2.
Apa produk dari reaksi CH3-C≡C-
dengan 2-bromopropane?
DAFTAR PUSTAKA
Katz, T. J.;
McGinnis, J. J. Am. Chem. Soc. 1975, 97, 1592.
Kürti, L. Czakó, B.
Strategic Applications of Named Reactions in Organic Synthesis; Elsevier
Academic Press: Burlington, MA 2005.
Mortimer, E. C.;
General Chemistry, Sixth Edition 1986.
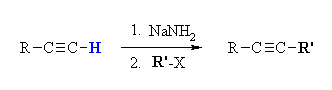







terimakasih tiur, menurut saya untuk pertanyaan pertama Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
BalasHapusHal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
BalasHapusSaya akan mnjwb pertanyaan ke 1, Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
BalasHapusterima kasih materinya, menurut saya jawaban no1 yaitu Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
BalasHapusTerimakasih untuk materinya tiur. Saya akan menjawab.
BalasHapus1. Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
Terimakasih materinyaa..
BalasHapussaya akan mencoba menjawab permasalahan anda.
1.Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi bukan reaksi substitusi.
2.Produk berupa 4-methyl-2-pentuna. dimana Ion acetylide memiliki atom C kaya elektron sehingga bereaksi sebagai nukleofil. Alkil halida sekunder bersifat elektrofilik di pusat C-X dan mengalami reaksi SN2 sehingga membentuk C-C baru dalam alkuna.
terimakasih...
terima kasih materinya
BalasHapussaya akan coba menjawab
Answer :
1. Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
2. 4-methyl-2-pentyne. Ion acetylide memiliki atom C kaya elektron sehingga bereaksi sebagai nukleofil. Alkil halida sekunder bersifat elektrofilik di pusat C-X dan mengalami reaksi SN2 sehingga membentuk C-C baru dalam alkuna internal baru
terimakasih tiur, menurut saya untuk pertanyaan pertama Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
BalasHapusTerimakasih atas materi yang disampaikan tiur
BalasHapusSaya akan menjawab pertanyaan yang pertama
1.Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi bukan reaksi substitusi.
Terimakkasih untuk penjelasanya ..
BalasHapusmenurut saya untuk no
1. Dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
Menurut saya untuk jawaban no. 1 alkilasi ion asetilida hanya terbatas pada alkil bromida primer dan alkil iodida saja hal ini di karenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaski ddhidrohalogenasi bukan reaski substitusi
BalasHapusMateri yang menarik Tiur, menurut saya untuk pertanyaan pertama Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
BalasHapusuntuk nomor 2 4-methyl-2-pentyne. Ion acetylide memiliki atom C kaya elektron sehingga bereaksi sebagai nukleofil. Alkil halida sekunder bersifat elektrofilik di pusat C-X dan mengalami reaksi SN2 sehingga membentuk C-C baru dalam alkuna internal baru
BalasHapusHayy tiurr
BalasHapusSaya akan mencoba menjawab pertanyaan nmr 1
Mnrut saya Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
Trims
Saya akan mencoba menjawab pertanyaan pertama, dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
BalasHapusHai Tiur, menurut saya :
BalasHapus1. Kenapa Alkilasi ion asetilida hanya terbatas pada alkil bromida primer dan alkil iodida saja? itu karena anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitus
2. produk reaksi propuna dengan 2 bromo pentane yakni akan menghasilkan produk 4 metil 2 pentuna dimana ion acetilida memiliki atom C kaya elektron sehingga dia berperan sebagai nukleofil. Alkil halida sekunder bersifat elektrofilik di pusat C-X dan mengalami reaksi SN2 sehingga membentuk C-C baru dalam alkuna internal baru
terimakasih :)
Terimakasih tiur,
BalasHapusMenurut saya,jawaban atas pertanyaan anda Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
Hai tiur
BalasHapusSaya akan mnjwb pertanyaan yg pertama, Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
terimakasih materinya tiur, menurut saya untuk pertanyaan pertama Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
BalasHapusterima kasih tiur, menurut saya untuk pertanyaan no 1 yaitu Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
BalasHapusHai tiur,
BalasHapusSaya akan mencoba menjawab no 1
Kenapa Alkilasi ion asetilida hanya terbatas pada alkil bromida primer dan alkil iodida saja?
Hal ini karena anion asetilida merupakan nukelofil sekaligus basa kuat, sehingga jika bereaksi dengan alkil halida tersier, justru akan terjadi reaksi eliminasi dibandingkan substitusi Nukleofil.
Sekian :)
Terimakasih materinyaa..
BalasHapussaya akan mencoba menjawab pertanyaan yg ada
Menurut saya
1.Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi bukan reaksi substitusi.
2.Produk berupa 4-methyl-2-pentuna. dimana Ion acetylide memiliki atom C kaya elektron sehingga bereaksi sebagai nukleofil. Alkil halida sekunder bersifat elektrofilik di pusat C-X dan mengalami reaksi SN2 sehingga membentuk C-C baru dalam alkuna.
menurut saya untuk pertanyaan pertama yaitu : Hal tersebut dikarenakan anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halida sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi bukan reaksi substitusi.
BalasHapusMenurut saya Hal ini karena anion asetilida merupakan nukelofil sekaligus basa kuat, sehingga jika bereaksi dengan alkil halida tersier, justru akan terjadi reaksi eliminasi dibandingkan substitusi Nukleofil.
BalasHapusMenurut saya Hal ini karena anion asetilida merupakan nukelofil sekaligus basa kuat, sehingga jika bereaksi dengan alkil halida tersier, justru akan terjadi reaksi eliminasi dibandingkan substitusi Nukleofil.
BalasHapus