PEMBENTUKAN
IKATAN C-C, PENYERANGAN ELEKTROFILIK DAN NUKLEOFILIK
2,2,3-trimethylpentane
Atom
karbon sebagai basis senyawa organik, adalah atom yang memiliki enam elektron
dengan konfigurasi 1s2 2s2 2p2. Atom karbon mempunyai empat elektron valensi.
Dengan empat elektron valensi tersebut, atom karbon dalam membentuk ikatan
dengan atom lainnya tidak mempunyai kecenderungan melepaskan keempat
elektronnya untuk memenuhi aturan oktet, sehingga dapat membentuk ion positif
C4+, atau menerima empat elektron sehingga menjadi ion negatif C4-. Sebaliknya,
empat elektron pada kulit terluar dapat membentuk empat ikatan kovalen baik
dengan atom karbon maupun dengan atom lain, melalui pemakaian bersama pasangan elektron.
Misalnya, karbon bergabung dengan empat atom hidrogen membentuk molekul CH4
atau metana. Setiap atom hidrogen menyumbangkan satu elektron, sehingga
terdapat empat pasang elektron yang digunakan membentuk ikatan antara C dan H.
Karbon dapat juga menggunakan pasangan elektron bersama dengan empat atom
klorin, membentuk CCl4. Ikatan pada senyawa organik dapat digambarkan dengan
struktur Lewis, maupun struktur Kekule. Pada struktur Lewis, elektron valensi
dari suatu atom ditunjukkan sebagai noktah (titik). Hidrogen mempunyai satu
titik, mewakili elektron 1s-nya, sedangkan karbon mempunyai empat titik yang menunjukkan
empat elektron pada 2s2 dan 2p2. Setiap ikatan kovalen ditandai oleh peletakan
dua titik di antara dua atom. Elektron-elektron diatur untuk memenuhi aturan
oktet. Pada struktur ini dimungkinkan terdapat pasangan elektron yang tidak
digunakan untuk berikatan, yang sering disebut pasangan elektron bebas. Struktur
Kekule atau struktur ikatan-garis mempunyai sebuah garis yang digambarkan di
antara dua atom yang menunjukkan dua elektron berikatan kovalen. Atom-atom
dengan satu, dua, atau tiga elektron valensi membentuk satu, dua, atau tiga
ikatan. Atom-atom dengan empat elektron valensi atau lebih membentuk ikatan
sebanyak yang diperlukan untuk memenuhi aturan oktet. Karbon yang mempunyai 4
elektron valensi membentuk 4 ikatan kovalen, nitrogen yang mempunyai lima
elektron valensi hanya membentuk 3 ikatan kovalen, oksigen yang mempunyai enam
elektron valensi membentuk 2 ikatan kovalen, dan flour yang mempunyai tujuh
elektron valensi membentuk hanya 1 ikatan kovalen.
Sifat khas atom karbon, suatu sifat yang memungkinkan
keberadaan jutaan senyawa organik, adalah kemampuannya untuk membentuk ikatan tidak
saja dengan unsur berbeda, tetapi juga dengan atom karbon lain. Kemampuan
atom-atom karbon untuk membentuk ikatan kovalen memungkinkan terbentuknya
rantai karbon yang beragam. Hal ini merupakan salah satu penyebab begitu banyak
senyawa karbon yang dapat terbentuk. Rantai karbon dapat merupakan rantai
lurus, bercabang, maupun siklis.
Empat
ikatan kovalen yang dapat terbentuk antar atom C dapat berupa ikatan tunggal
atau ikatan rangkap, tergantung dari orbital yang digunakan masing-masing atom
karbon tersebut.
Pada etana atau H3C-CH3,
dua karbon membentuk ikatan satu sama lain
melalui overlap orbital sp3 dari setiap karbon membentuk satu ikatan
sigma (σ). Tiga orbital sp3 lain
pada setiap karbon overlap dengan orbital 1s atom H untuk membentuk enam ikatan
σ C-H.
a. Hibridisasi sp3
Atom larbon memiliki dua
orbital (2s dan 2p) untuk membentuk ikatan, artinya jika bereaksi dengan
hidrogen maka akan terbentuk dua ikatan C-H. Faktanya, atom karbon membentuk
empat ikatan C-H dan menghasilkan molekul metana dengan bentuk bangun ruang tetrahedron.
Linus Pauling (1931) menjelaskan secara matematis bagaimana orbital s dan tiga
orbital p berkombinasi atau terhibridisasi membentuk empat orbital atom yang
ekuivalen dengan bentuk tetrahedral. Orbital yang berbentuk tetrahedral disebut
dengan hibridisasi sp3. Angka tiga menyatakan berapa banyak tipe orbital atom
yang berkombinasi, bukan menyatakan jumlah elektron yang mengisi orbital. Atom
karbon memiliki konfigurasi ground-state 1s2 2s2 2px1 2py1. pada kulit terluar
terdapat dua elektron dalam orbital 2s, dan dua elektron tak perpasangan dalam
orbital 2p:
b. Hibridisasi sp2
Orbital dan Struktur
Etilen Ketika kita membentuk orbital hibridisasi sp3 untuk menjelaskan ikatan
dalam metana, pertama kali yang dilakukan adalah mempromosikan satu elektron
dari orbital 2s ke excited state menghasilkan empat elektron tak berpasangan.
Hibridisasi sp2 terjadi jika satu elektron tereksitasi ke orbital p. Akibatnya,
atom karbon yang terhibridisasi sp2 hanya dapat membentuk tiga ikatan sigma dan
satu ikatan pi. Ikatan pi terjadi sebagai akibat dari tumpang tindih elektron
pada orbital 2p-2p.
Dua
atom karbon sp2 dapat saling membentuk ikatan yang kuat, mereka membentuk
ikatan sigma melalui overlap orbital sp2-sp2. Kombinasi ikatan sigma sp2-sp2 dan
ikatan pi 2p-2p menghasilkan bentuk ikatan rangkap karbon-karbon. Bentuk bangun
ruang dari ikatan atom karbon yang terhibridisasi sp2 adalah trigonal planar.
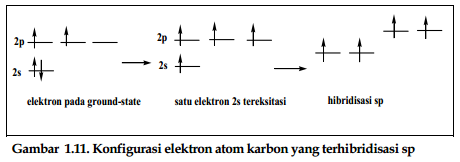
c. Hibridisasi sp
Atom karbon memiliki
kemampuan membentuk tiga macam ikatan, yaitu ikatan tunggal, rangkap dua dan
rangkap tiga. Asetilena, C2H2, contoh paling sederhana dari ikatan
karbon-karbon rangkap tiga. Di samping dapat berkombinasi dengan dua atau tiga
orbital p, hibrida orbital 2s juga dapat berkombinasi dengan satu orbital p.
Orbital sp memiliki bangun
ruang linear dengan sudut ikatan H-C-C sebesar 180̊
yang telah terverifikasi dari hasil eksperimental. Panjang ikatan H-C sebesar
1.06 A dan panjang ikatan C-C adalah 1.20 A.
(a) Ikatan
σ C-C terbentuk karena
overlap orbital sp-sp dan ikatan C-H dibentuk karena overlap orbital sp-s. (b)
dua ikatan π
karbon-karbon terbentuk melalui overlap orbital p yang berhadap-hadapan antara
atom karbon yang satu dengan atom karbon lainnya.
Ikatan
karbon-karbon adalah ikatan kovalen antara dua atom karbon. Bentuk yang paling
umum adalah ikatan tunggal: ikatan yang tersusun atas dua elektron, satu dari
masing-masing dua atom. Ikatan tunggal karbon-karbon adalah ikatan sigma dan
dikatakan terbentuk dari satu orbital hibrid dari masing-masing atom karbon.
Dalam etana, orbital sp3 adalah orbital hibrid, tetapi ikatan
tunggal terbentuk antara atom karbon dengan hibridisasi lain memang terjadi
(misalnya sp2 ke sp2). Bahkan, atom karbon dalam
ikatan tunggal tidak perlu dari hibridisasi yang sama.
Karbon
adalah salah satu dari beberapa elemen yang dapat membentuk rantai panjang atom
sendiri, yang disebut katenasi. Hal ini ditambah dengan kekuatan ikatan
karbon-karbon menimbulkan sejumlah besar bentuk molekul, banyak yang merupakan
elemen struktural penting dari kehidupan, sehingga senyawa karbon memiliki
bidang mereka sendiri studi: kimia organik.
Percabangan
juga sering terjadi pada C-C kerangka. Atom karbon yang berbeda dapat
diidentifikasi sehubungan dengan jumlah karbon tetangga:
1) atom
karbon primer: satu atom karbon tetangga
2) atom
karbon sekunder: dua atom karbon tetangga
3) tersier
atom karbon: tiga atom karbon tetangga
4) kuartener
atom karbon: empat atom karbon tetangga
Sintesis
Reaksi ikatan pembentukan karbon-karbon adalah reaksi
organik di mana ikatan karbon-karbon baru terbentuk. Mereka penting dalam
produksi bahan kimia buatan manusia seperti obat-obatan dan plastik.
Pembentukan
Ikatan C-C
1
. Melalui reaksi radikal bebas
Tidak
terkendali, dapat melakukan reaksi berantai (tidak digunakan dalam sintesis).
2
. Melalui reaksi antara C+ dengan C-
Lebih terkendali (digunakan dalam
sintesis).
Contoh lain reaksi yang membentuk ikatan karbon-karbon
adalah reaksi Aldol, reaksi Diels-Alder, penambahan reagen Grignard ke grup
karbonil, reaksi Heck, reaksi Michael dan reaksi Wittig.
A. Reaksi Substitusi Nukleofililk
Nukleofilisitas
merupakan ukuran kemampuan sutau pereaksi yang menyebabkan terjadinya suatu
reaksi subtitusi. Reaksi
substitusi nukleofilik dibagi menjadi dua tahapan yaitu reaksi substitusi
nukleofilik unimolekuler dan reaksi nukleofilik bimolekuler.
v
Reaksi substitusi nukleofilik
unimolekuler
(SN1)
Reaksi substitusi nukleofilik unimolekuler (SN1) terjadi
melalui dua tahapan. Pada tahap pertama, ikatan antara
karbon dan gugus bebas putus, atau substrat terurai. electron – electron ikatan
terlepas bersama dengan gugus bebas, dan terbentuklah ion karbonium. Pada tahap kedua, yaitu tahap cepat,
ion karbonium bergabung dengan nukleofil akan membentuk hasil.
Mekanisme reaksi substitusi nukleofilik unimolekuler, SN1
Mekanisme reaksi SN1
hanya terjadi pada alkil halida tersier. Nukleofil yang dapat menyerang
adalah nukleofil basa sangat lemah seperti H2O, CH3CH2OH. Pada
reaksi SN1 terdiri
dari 3 tahap reaksi. Sebagai
contoh adalah reaksi antara t-butil bromida dengan air.
Tahap 1.
Tahap 2.
Tahap 3.
Kecepatan reaksi akan ditentukan oleh seberapa cepat halogenalkana
terionisasi. Karena tahapan awal yang lambat ini hanya melibatkan satu spesies,
maka mekanisme ini disebut sebagai SN1 – substitusi, nukleofilik,
satu spesies yang terlibat dalam tahap awal yang lambat.
v Tahapan reaksi substitusi nukleofilik bimolekuler, SN2
Nukleofil
menyerang dari belakang ikatan C—X. Pada keadaan transisi, nukleofil dan gugus
pergi berasosiasi dengan karbon di mana substitusi akan terjadi. Pada saat gugus pergi terlepas dengan membawa pasangan electron,
nukleofil memberikan pasangan elektronnya untuk dijadikan pasangan elektron
dengan karbon.
Diagram perubahan energi reaksi
SN2
Mekanisme
reaksi substitusi nukleofilik biomolekul, SN2
Mekanisme reaksi SN2
hanya terjadi pada alkil halida
primer dan sekunder. Nukleofil yang menyerang adalah jenis nukleofil
kuat seperti -OH, -CN, CH3O-.
Serangan dilakukan dari belakang. Untuk lebih jelas, perhatikan contoh reaksi
mekanisme SN2 bromoetana dengan ion hidroksida berikut ini.
Peranan gugus tetangga pada mekanisme reaski SN2 :
ü Sebagai
gugus yang memberikan suatu reaksi intermediate yang baru
pada pusat reaksi
ü Dengan
adanya partisipasi gugus tetangga, konfigurasi produk sama dengan substrat. Partisipasi
gugus tetangga ini juga dapat mempengaruhi kecepatan reaksi. Jika suatu gugus
tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan
kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai “anchimeric
assistance”.
üGugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi
dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah
serangan dari nukleofilik, sehingga nukleofilik hanya dapat bereaksi dengan
atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal. Atom
atau gugus yang dapat meningkatkan laju SN2 melalui partisipasi
gugus tetangga ialah nitrogen dalam bentuk amina, oksigen dalam bentuk
karboksilat dan ion alkoksida,
dan cincin aromatik. Partisipasi hanya efektif jika interaksinya membentuk
cincin segitiga, lima dan enam.
v Mekanisme reaksi SNi
Sebagai contoh adalah reaksi antara t-butil bromida
dengan air.
Tahap 1.
Tahap 2.
Tahap 3.
Teori pasangan ion
pada reaksi substutitusi nukleofilik
Reaksi ini dengan mengambil contoh sebuah halogenalkana primer,
yaitu bromoetana sebagai halogenalkana primer sederhana. Bromoetana memiliki
sebuah ikatan polar antara atom karbon dan bromin.
Salah satu pasangan elektron bebas pada ion
OH- akan tertarik kuat ke atom karbon
+, dan akan bergerak kearahnya, mulai
membentuk sebuah ikatan dengannya. Ion negatif yang mendekat akan mendorong
elektron-elektron dalam ikatan karbon-bromin semakin dekat ke bromin.
v Perubahan stereokimia substrat pada reaksi SN1
dan SN2
Dalam
mekanisme SN2, nukleofil akan membentuk tahap transisi dengan
molekul yang lepas saja yang terlekang. Kedua mekanisme ini berbeda pada hasil stereokimianya.
Reaksi SN1 menghasilkan adisi non-stereospesifik dan tidak
menghasilkan pusat chiral, melainkan dalam bentuk isomer geometri
(cis/trans). Kebalikannya, inversi Warden-lah yang diamati pada
mekanisme SN2
B. Elektrofilik Senyawa Alifatis
Elektrofilitas
merupakan
sesuatu yang tertarik pada elektron, Dan karena tertarik oleh daerah negatif,
elektrofil harus merupakan sesuatu yang memebawa muatan positif penuh atau
memiliki sedikit muatan positif disuatu daerah padanya.
v Tahapan reaksi substitusi elektrofilik unimolekuler, SE1
Tahap pertama
Seandainya elektrofil
merupakan ion positif X+. Dua dari elektron pada sisten yang
terdeloakalisai tertarik kearah X+ dan membentuk ikatan. Sehingga
terjadi pemutusan dislokalisasi, walaupun tidak seluruhnya.
Ion yang terbentuk pada tahap ini bukan merupakan hasil akhir. Tahap
ini hanya merupakan tahap antara. Hasilnya merupakan hasil
antara.
Masih terjadi delokalisasi pada hasil
antara, namun hanya pada sebagian daerah dari ion. Ion pada hasil antara
bermuatan positif sebagai hasil dari penggabungan molekul netral dan ion
positif. Muatan positif ini lalu menyebar sepanjang daerah yang terdelokalisasi
pada cincin. Anda cukup menggambarkan “+” pada bagian tengah cincin untuk
menunjukkan hal ini. Hidrogen pada bagian bagian atas dari gambar bukanlah
hidrogen yang baru, hidrogen tersebut sudah berikatan pada carbon yang sama
sebelum reaksi. Dan untuk lebih memperjelas reaksi selanjutnya hidrogen
tersebut perlu dituliskan.
Tahap kedua
Disini kita akan memerkenalkan ion baru, Y-.
Darimana ini datang? Anda harus ingat bahwa tidak mungkin untuk mendapatkan
positif ion saja pada suatu sistem kimia. Jadi ion Y- merupakan ion
yang sebelumnya berikatan dengan X+.
Elektron tidak berpasangan pada Y-membentuk
ikatan dengan atom hidrogen pada bagian atas dari cincin. Ini berarti bahwa
pasangan dari elektron yang menghubungkan hidrogen dengan cincin tidak
diperlukan lagi. Bagian tersebut lalu bergerak kebawah dan mengisi ruang kosong
pada daerah dislokalisasi elektron dan mengembalikan dislokalisasi elektron
seperti semula. Sehingga stabilitas benzen-pun kembali.
Mekanisme reaksi E1 merupakan
alternatif dari mekanisme reaksi SN1. Karbokation dapat memberikan sebuah
proton kepada suatu basa dalam reaksi eliminasi.
Mekanisme reaksi E1 terdiri dari dua tahap, yaitu :
Mekanisme reaksi E1 terdiri dari dua tahap, yaitu :
·
Tahap
1, yang merupakan
reaksi E1 yang berjalan lambat.
·
Tahap
2, yang merupakn
reaksi E1 yang dengan berjalan cepat.
v Mekanisme reaksi substitusi elektrofilik unimolekuler, SE1
Mekanisme reaksi E1 terdiri dari dua tahap.
Perhatikan contoh berikut ini.
Tahap 1.
Tahap 1.
Tahap
1 reaksi E1 berjalan lambat
Tahap2.
Tahap 2 reaksi E1 berjalan cepat
Tahap 2 reaksi E1 berjalan cepat
Mekanisme reaksi
SE1
Mekanisme reaksi E1
merupakan alternatif dari mekanisme reaksi SN1. Karbokation dapat
memberikan sebuah proton kepada suatu basa dalam reaksi eliminasi.
Mekanisme reaksi E1 terdiri dari dua tahap, yaitu : Tahap 1, yang merupakan reaksi E1 yang berjalan lambat. Tahap 2, yang merupakn reaksi E1 yang dengan berjalan cepat.
Mekanisme reaksi E1 terdiri dari dua tahap, yaitu : Tahap 1, yang merupakan reaksi E1 yang berjalan lambat. Tahap 2, yang merupakn reaksi E1 yang dengan berjalan cepat.
v Tahapan reaksi substitusi elektrofilik bimolekuler, SE2
Reaksi E2 menggunakan basa kuat seperti -OH,
-OR, dan juga membutuhkan kalor. Pada reaksi
SE2 ini terjadi dengan satu tahap. Dengan memanaskan alkil halida dalam KOH, CH3CH2ONa.
Mekanisme
reaksi substitusi elektrofilik bimolekuler, SE2
Pada reaksi SE2 ini
terjadi dengan satu tahap.
Dengan memanaskan alkil halida dalam KOH, CH3CH2ONa.
v
perubahan
stereokimia substrat pada reaksi SE1 dan SE2
Permasalahan yang timbul :
1. Mengapa ikatan C-C memiliki energy lebih besar dibandingkan dengan ikatan C=C atau ikatan C≡C?
2.Mengapa gugus tetangga berpengaruh terhadap reaksi nukleofilik?
DAFTAR
PUSTAKA
Firdaus.
2013. Modul
Pembelajaran Matakuliah Kimia Organik Fisik II.
Makassar: Universitas Hasanuddin Press.





























Terimakasih atas penjelasannya tiur, saya akan mencoba menjawab pertanyaannya
BalasHapus1.hal ini dikarenakan cara bertumpang tindih orbital yang berbeda, pada ikatan C-C bertumpang tindih pada ikatan sigma sedangkan C=C dan C rangkap 3 yang bertumpang tindih pada ikatan phi
Ikatan sigma memiliki ikatan yang lebih kuat dari ikatan phi
Terimakasih :)
terima kasih tiur atas materinya
BalasHapussaya akan menjawab pertanyaan no 1
menurut saya hal inni dikarnakan Ikatan C-C bertumpang tindih di ikatan sigma yang mana kita ketahu untuk C=C terikat pada ikatan phi yang mana ikatan phi sendiri lebih rendah dari ikatan sigma sebitu pula untuk ikatan rangkap 3
Terima kasih atas materinya tiur
BalasHapus2. Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yabg menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat berinteraksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal. Atom atau gugus yg dpat meningkatkan laju SN2 melalui partisipasi gugus tetangga adalah nitrogen dalam bentuk amina,oksigen dalam bentuk karboksilat dan ion alkoksida dan cincin aromatik. Partisipasi hanya efektif jika interaksinya membentuk cincin segitiga lima dan enam.
Terimakasih atas materinnya menurut saya pertanyaan no 2.Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yabg menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat berinteraksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal. Atom atau gugus yg dpat meningkatkan laju SN2 melalui partisipasi gugus tetangga adalah nitrogen dalam bentuk amina,oksigen dalam bentuk karboksilat dan ion alkoksida dan cincin aromatik. Partisipasi hanya efektif jika interaksinya membentuk cincin segitiga lima dan enam.
BalasHapusBaiklah saya akan mencoba menjawab pertanyaan tiur untuk yang nomor dua dimana Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat berinteraksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal. Atom atau gugus yang dapat meningkatkan laju SN2 melalui partisipasi gugus tetangga adalah nitrogen dalam bentuk amina,oksigen dalam bentuk karboksilat dan ion alkoksida dan cincin aromatik. Partisipasi hanya efektif jika interaksinya membentuk cincin segitiga lima dan enam.
BalasHapusTerimakasih atas materi yang disampaikan
BalasHapusSaya akan menjawab pertannyan nomor 2
Menurut saya Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat berinteraksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal. Atom atau gugus yang dapat meningkatkan laju SN2 melalui partisipasi gugus tetangga adalah nitrogen dalam bentuk amina,oksigen dalam bentuk karboksilat dan ion alkoksida dan cincin aromatik. Partisipasi hanya efektif jika interaksinya membentuk cincin segitiga lima dan enam.
Semoga bermanfaat
materi yang sangat menarik, dimana Gugus tetangga dapat menggunakan pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat berinteraksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi awal. Atom atau gugus yang dapat meningkatkan laju SN2 melalui partisipasi gugus tetangga adalah nitrogen dalam bentuk amina,oksigen dalam bentuk karboksilat dan ion alkoksida dan cincin aromatik. Partisipasi hanya efektif jika interaksinya membentuk cincin segitiga lima dan enam.
BalasHapus